CECHY MAKROSKOPOWE


|
Owocniki bulwiaste, o regularnych owalnych lub kulistych kształtach ale zawsze z licznymi wgłębieniami, depresjami, a czasem kanalikami biegnącymi do wewnątrz owocnika Wielkość dojrzałych owocników 0,3-1,3 cm. Powierzchnia owocnika za młodu biała, potem biało-kremowa, w stadium pełnej dojrzałości kremowo-ochrowa z nielicznymi ciemniejszymi plamami. Młode owocniki w całości pokryte delikatnymi, zamszowatymi, białymi włoskami. Włoski bardzo nietrwałe i podatne na ścieranie. W późniejszym wieku pozostałości włosków można zaobserwować jedynie w nierównościach perydium. Poza tym powierzchnia owocnika woskowata, a w trakcie suchej pogody matowa. Perydium bardzo cienkie, >2 mm grubości. Gleba najpierw szklistobiała, potem kremowa w końcu ochrowa do brązowej z delikatnym, mięsnoróżowym odcieniem. Poprzecinana licznymi, białymi żyłkami o chaotycznym przebiegu. Miąższ zwarty, woskowaty o mdłym smaku i bez charakterystycznego zapachu.
|
CECHY MIKROSKOPOWE
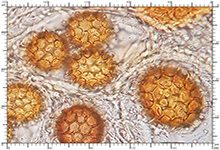
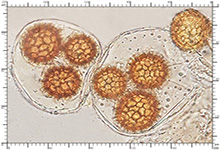 Zarodniki w KOH 3% Zarodniki w KOH 3%
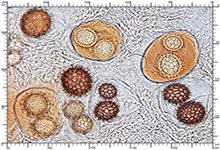 Zarodniki w odczynniku Melzera Zarodniki w odczynniku Melzera
|
Perydium dwuwarstwowe o grubości 90-180 μm. Zewnętrzna warstwa suprapellis pseudoparenchymatyczna, zbudowana z izodiametrycznych, grubościennych, okrągławych komórek o średnicy 5-20 μm. Wewnętrzna warstwa subpellis plektenchymatyczna, zbudowana z cienkościennych, septowanych, hialinowych strzępek o grubości 2-4 μm. Powierzchnia młodych owocników w całości pokryta delikatnymi, włoskowatymi dermatocystydami 4-7 x 25-70 μm. Dermatocystydy cylindryczne, obłe na szczycie, czasem lekko rozszerzone, zawsze z 1-2 septami. Dermatocystydy sukcesywnie zanikają w trakcie wzrostu owocnika (patrz: uwagi) – i w dojrzałych okazach można zaobserwować co najwyżej cienką, powierzchniową warstwę ich pozostałości. Worki owalne, lub kuliste, czasem na krótkich trzonkach. Wielkość worków 80-100 x 65-90 μm. Worki 1-3 zarodnikowe – bardzo rzadko z większą liczbą zarodników. Zarodniki szerokoowalne, żółtawe do żółto-brązowych, w KOH pomarańczowo-żółte. Wielkość zarodników zależna od ich ilości w worku, 35-55 x 25-40 μm, Q=1,05-1,2. Zarodniki pokryte wyraźną siateczką alweoli o średniej wielkości 3-6 μm. Kąty siateczki wyciągnięte w kolce o długości 1-4 μm. Na dłuższej osi zarodnika (4)5-7 alweoli.
 |
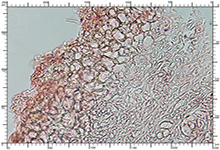 |
 |
Perydium dojrzałego okazu |
Dwuwarstwowe perydium |
Worki |
|
SIEDLISKO
 Zagajnik Pseudotsuga menziesii Zagajnik Pseudotsuga menziesii
|
Tuber anniae wyrasta wyłącznie w borach iglastych, na ubogich glebach bielicowych lub brunatnych o pH 5,1-6,2. Mikoryzuje z wieloma gatunkami drzew iglastych. W polskich warunkach stwierdzonym partnerem mikoryzowym jest Pinus sylvestris oraz Pseudotsuga menziesii. Owocniki wyrastają na granicy iglastej ściółki oraz właściwej gleby, nie głębiej niż 1-3 cm pod jej powierzchnią. Często pod płatami mchu. Zawsze w licznych grupach. W polskich warunkach dojrzałe owocniki można zbierać od września do listopada, choć młode okazy pojawiają się już wczesnym latem.
|
WYSTĘPOWANIE
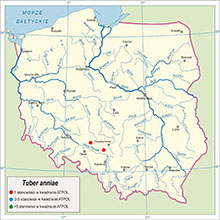
|
Tuber anniae jest gatunkiem znanym z kilku lokalizacji w USA i Meksyku oraz jednego stanowiska w Finlandii. W Polsce znaleziony na dwóch stanowiskach na Wyżynie Śląskiej oraz Nizinie Śląskiej. W chwili odkrycia tego gatunku nie były znane inne doniesienia o jego występowaniu na obszarze Polski.
Nizina Śląska – CE 77, Szumirad k. Ozimka, Lipiec 2017
Wyżyna Śląska – DF02, Psary k. Tarnowskich Gór, Czerwiec 2021
|
UWAGI
 Dojrzały owocnik Dojrzały owocnik
|
Tuber anniae należy do słabo poznanego, bogatego w gatunki niewielkich trufli, kladu Puberulum. Po raz pierwszy opisana ze stanowisk na zachodnim wybrzeżu Ameryki Północnej oraz Alaski, a następnie z Finlandii oraz Meksyku. Znaleziska z tak odległych i różnych ekologicznie stanowisk, wykazują subtelne różnice w budowie makro- i mikroskopowej i uznawane są za wspólny kompleks gatunkowy.
Zarówno badacze kolekcji północnoamerykańskich jak i fińskich uznali charakterystyczne dla gatunku, drobne, kruche dermatocystyd perydialne za bardzo trudne lub wręcz niemożliwe do obserwacji w związku z ich niszczeniem w trakcie pobierania owocników i przygotowywania preparatów. Periodyczne (co 14 dni) badania żywych owocników, pobieranych z gleby bez naruszania ich struktury powierzchniowej pozwoliły zaobserwować naturalny proces destrukcji dermatocystyd, wynikający prawdopodobnie ze zwiększającego się w trakcie wzrostu owocnika - nacisku gleby na jego powierzchnię. |
![]()